Se ha demostrado que las infusiones semanales de AMONDYS 45 (casimersen) ayudaron al cuerpo a producir una forma más corta de la proteína distrofina.a
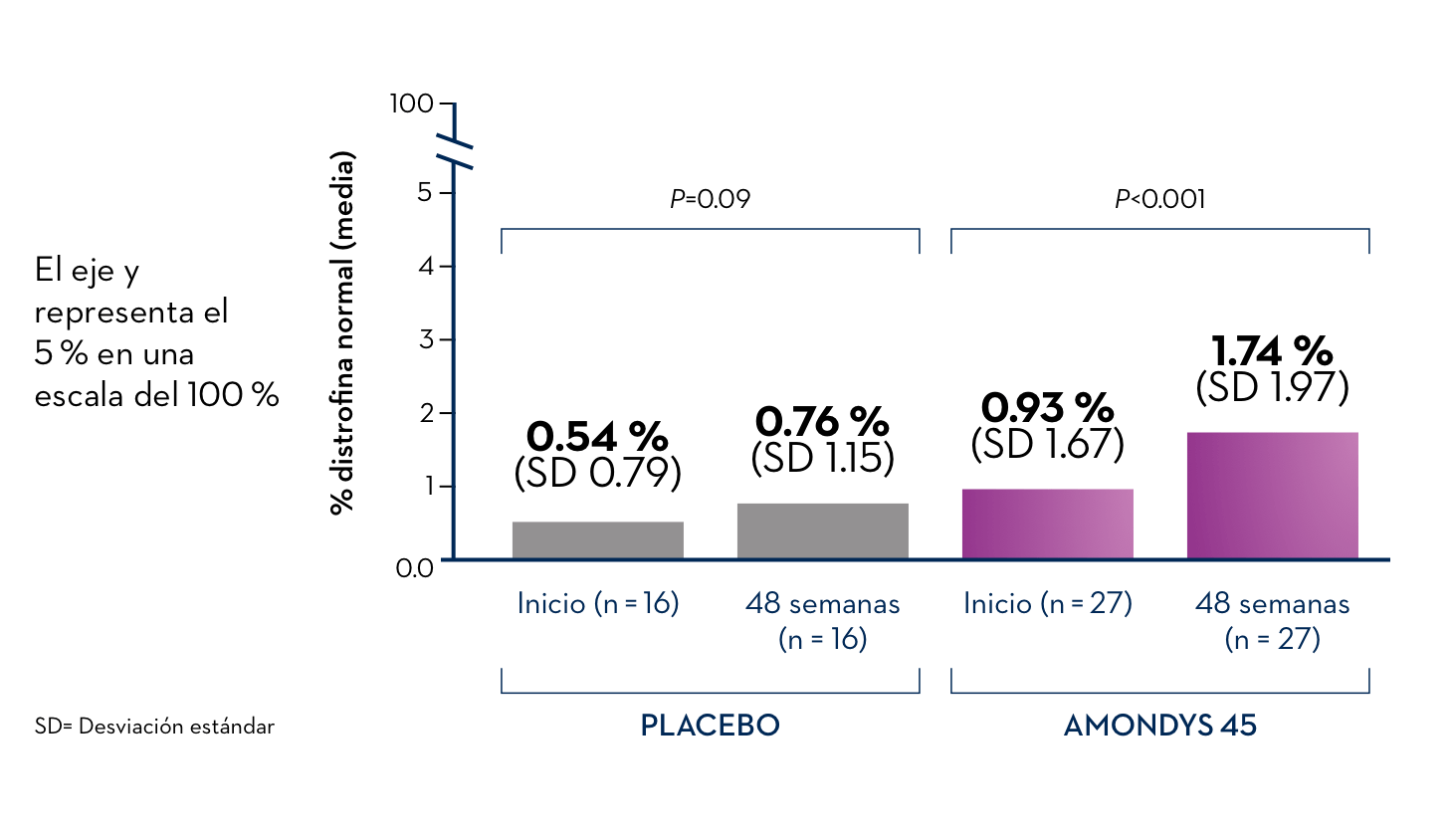
aLos niños varones tratados con AMONDYS 45 mostraron diversos niveles de aumento de la producción de distrofina después de 48 semanas. Los datos de un estudio clínico en curso mostraron que 27 niños varones (mediana de edad de 9 años) que recibían AMONDYS 45 presentaban un nivel promedio del 1.74 % de la producción normal de distrofina en comparación con el 0.76 % en 16 niños varones que recibieron una infusión de placebo.

Información sobre AMONDYS 45.
AMONDYS 45 es un tratamiento para la distrofia muscular de Duchenne (DMD). Utiliza una tecnología denominada omisión de exón para ayudar al cuerpo a producir una forma más corta de la proteína distrofina.a AMONDYS 45 se administra en una infusión semanal.
AMONDYS 45 se utiliza para tratar a pacientes con distrofia muscular de Duchenne (DMD) que tienen una mutación confirmada en el gen de la distrofina que puede ser tratada mediante la omisión del exón 45.
Esta indicación está aprobada con aprobación acelerada según un aumento de la producción de distrofina en el músculo esquelético observado en pacientes tratados con AMONDYS 45. La aprobación continua para esta indicación puede estar supeditada a la verificación del beneficio clínico en ensayos confirmatorios.
aLos niños varones tratados con AMONDYS 45 mostraron diversos niveles de aumento de la producción de distrofina después de 48 semanas. Los datos de un estudio clínico en curso mostraron que 27 niños varones (mediana de edad de 9 años) que recibían AMONDYS 45 presentaban un nivel promedio del 1.74 % de la producción normal de distrofina en comparación con el 0.76 % en 16 niños varones que recibieron una infusión de placebo.
Resultados de un estudio clínico en curso sobre AMONDYS 45.
Los investigadores están realizando un estudio clínico de AMONDYS 45 para analizar diferentes aspectos del medicamento, incluso si desencadena la omisión del exón 45 en el gen de la distrofina. También analizaron la cantidad de distrofina producida, junto con su perfil de seguridad. AMONDYS 45 se estudió en niños varones que tenían una mutación confirmada en el gen de la distrofina que podía tratarse mediante la omisión del exón 45. Comprenda lo que esto significa.
Inspiración de Beck: Cómo se siente padecer Duchenne con AMONDYS 45
Acompañe a Beck y su familia mientras enfrentan la vida con distrofia muscular de Duchenne Descubra los diversos intereses de Beck, sus contribuciones a la comunidad con Duchenne y la motivación con respecto a su tratamiento ininterrumpido con AMONDYS 45.
Diseñado para omitir el exón 45.
Los pacientes que recibieron AMONDYS 45 (27 pacientes) mostraron un aumento significativo en la omisión de exón, en función de las biopsias musculares tomadas al inicio del estudio clínico y después de 48 semanas.
Este aumento significativo en la omisión de exón no se observó en los 16 pacientes que recibieron un placebo.

Los niveles de distrofina aumentaron en los participantes del ensayo clínico con respecto al inicio.
Un estudio clínico en curso de 27 niños varones con distrofia muscular de Duchenne comparó el nivel de distrofina en sus cuerpos antes de la primera infusión (inicio) de AMONDYS 45 con el nivel de distrofina después de 48 semanas de tratamiento con AMONDYS 45. Los resultados se compararon con los de 16 niños con Duchenne que recibieron placebo durante 48 semanas. Los resultados provisorios mostraron que las infusiones semanales de AMONDYS 45 ayudaron al cuerpo a producir una forma más corta de la proteína distrofina. La cantidad de distrofina producida varió en el estudio.
Nivel promedio de proteína distrofina en el tejido muscular en los pacientes susceptibles a la omisión del exón 45, evaluado mediante la técnica de Western blot de Sarepta
Los niveles de distrofina medidos mediante la técnica de Western blot pueden verse fuertemente afectados por las diferencias en la forma en que se procesa y analiza la muestra, el material de referencia utilizado y el método de cuantificación.
La comparación de los resultados de distrofina de otros métodos de medición requiere material de referencia estándar y estudios adicionales.
¿Qué sabemos a partir de los resultados?


![Los pacientes tratados con AMONDYS 45 demostraron un aumento significativamente mayor en los niveles de distrofina 0.81 % en comparación con el nivel normal desde el inicio hasta la semana 48 en compariación con los que recibieron placebo (0.22 % de lo normal [diferencia promedio de 0.59 %; P = 0.004])](/sites/amondys45/files/2025-06/2-1_results_increase-es.png)

¿Qué sucede con los riesgos? Los investigadores evaluaron los riesgos y la tolerabilidad de AMONDYS 45. Al igual que con cualquier medicamento, debe analizar con su médico los riesgos y los efectos secundarios relacionados con AMONDYS 45.
